
Toxicologie Juvénile : Adopter des Orphelins Thérapeutiques
Toxicologie Juvénile : Adopter des Orphelins Thérapeutiques
L’utilisation de modèles animaux pour tester l’innocuité de produits chimiques ou médicamenteux à usage humain a réussi à prévenir des dommages permanents ou la mort résultant de produits non testés chez d’innombrables personnes. Des tests de sécurité inappropriés avant la réglementation de la FDA ont entraîné de nombreuses maladies graves et des décès dus à des produits ménagers simples. L’empoisonnement de masse par Elixir Sulfanilamide en 1937 et le tollé public qui a suivi ont été l’impulsion qui a conduit à l’adoption de la Federal Food, Drug & Cosmetic Act en 1938.
Aujourd’hui, les fabricants de biens de consommation, y compris les produits pharmaceutiques, sont tenus de prouver que leurs produits sont sûrs pour une utilisation chez l’homme. Cependant, malgré les progrès réalisés en matière de tests de sécurité, le développement de médicaments standard s’est traditionnellement concentré sur les tests de sécurité en pensant aux consommateurs finaux adultes. Au fur et à mesure que la recherche se poursuit, il est devenu de plus en plus clair que les données des tests de sécurité générées par la recherche avec des adultes ne peuvent pas être facilement généralisées aux enfants.
À partir de 1994, la FDA a commencé à prendre davantage de mesures pour inclure des tests de sécurité pédiatriques dans le cadre du processus de développement de médicaments afin de réduire l’utilisation hors AMM dans la population pédiatrique. En 1994, la règle pédiatrique exigeait l’utilisation des données existantes pour appuyer un étiquetage supplémentaire à usage pédiatrique. La loi de modernisation de la FDA (FDAMA) en 1997 et la loi sur les meilleurs produits pharmaceutiques pour enfants (BPCA) en 2002 ont fourni des incitations à l’exclusivité du marché pour inclure les tests pédiatriques. La Pediatric Research Equity Act de 2003 a servi de bâton proverbial à la carotte de la BPCA. Le succès de ces réglementations a abouti à leur adoption permanente par le congrès américain en 2012. L’utilisation de médicaments hors AMM en pédiatrie est passée de 80 % en 1994 à 50 % en 2017.
L’ITR a travaillé au développement de nouvelles méthodes pour répondre à la demande de modèles animaux juvéniles. Dans ce bulletin, nous discutons des différences biologiques entre les enfants et les adultes, nous aborderons les défis et l’éthique de la recherche pédiatrique, l’utilité des modèles animaux pour la pédiatrie et comment l’ITR s’adapte pour inclure plus d’expertise dans les modèles animaux juvéniles et néonatals.

Différences Entre Enfants et Adultes
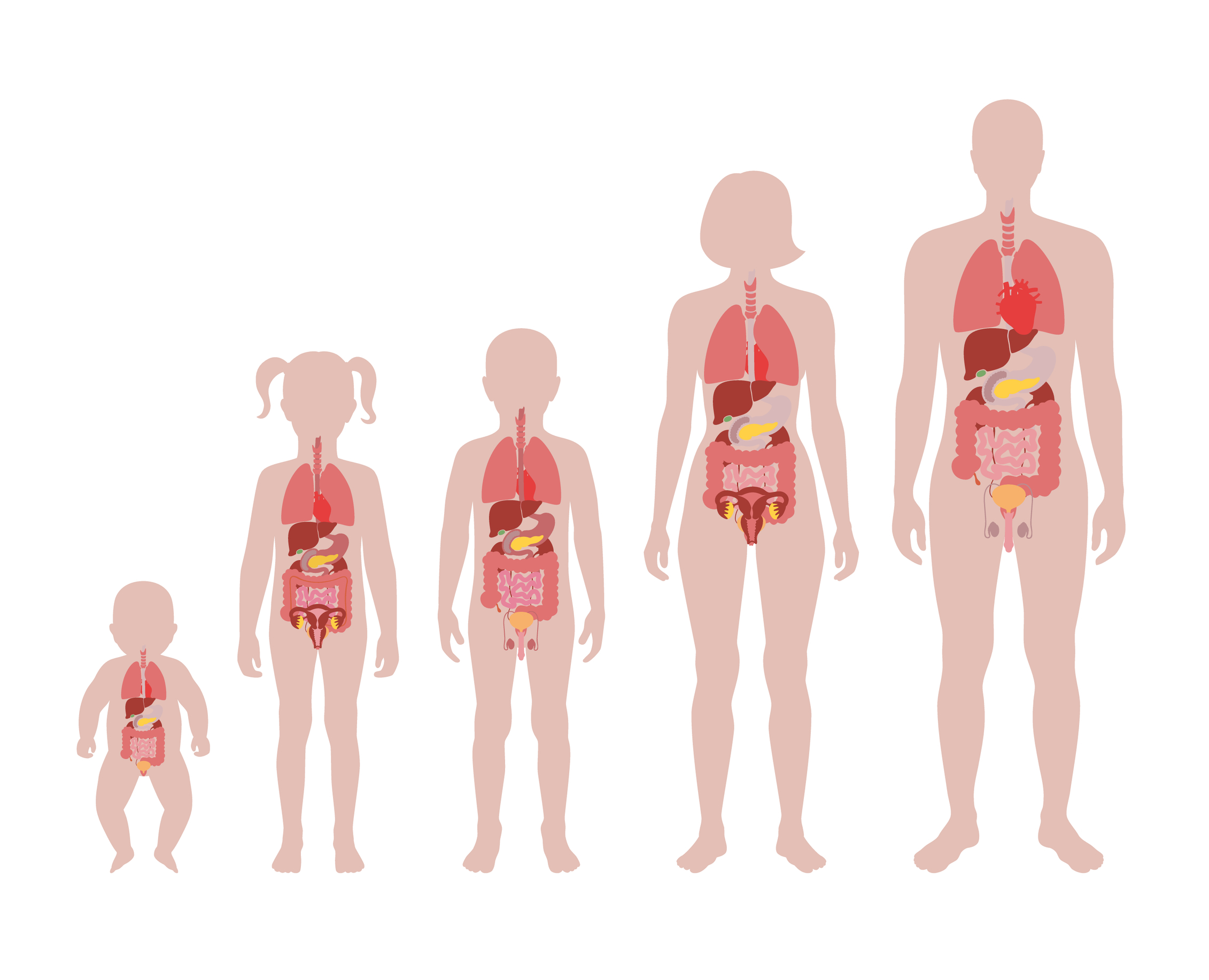
Les enfants présentent des différences d’absorption, de distribution, de métabolisme et d’élimination par rapport aux adultes et ces différences changeront en fonction du stade de développement actuel. Chaque système d’organes du corps se développe à des rythmes différents et passera par différents stades de développement en fonction de l’âge de l’enfant. Des systèmes comme les reins et les systèmes gastro-intestinaux arriveront à maturité dans un délai d’un an, tandis que les poumons arriveront à maturité dans un délai de 2 ans. À l’inverse, le cerveau reste un organe en développement constant jusqu’au début de l’âge adulte, jusqu’à environ 25 ans, semblable au système squelettique. Tous ces systèmes peuvent être perturbés ou modifiés par des médicaments. Les systèmes d’organes qui subissent un développement postnatal important sont les plus exposés aux effets négatifs de la toxicité des médicaments. Les reins, les poumons, le système immunitaire, le système gastro-intestinal, le système squelettique et le système reproducteur sont tous à risque lorsqu’on considère la toxicité potentielle des médicaments.
Problèmes avec les Essais Cliniques Pédiatriques et l’Utilité des Modèles Animaux
Au-delà des différences physiologiques et développementales chez les enfants par rapport aux adultes, les essais cliniques pédiatriques présentent également des limites éthiques. Les essais cliniques de médicaments nécessitent un consentement volontaire, clair et éclairé de la part des adultes qui choisissent de participer. La communication et le consentement sont complexes avec les jeunes enfants. S’assurer qu’un jeune enfant comprend les informations détaillées et comprend vraiment les risques potentiels liés à l’essai est beaucoup plus difficile qu’avec des adultes. Convaincre les parents de permettre à un enfant de participer à des essais cliniques de médicaments peut également être une entreprise difficile. En raison des problèmes éthiques difficiles impliqués, les modèles animaux ont été fortement utilisés pour le développement de médicaments pédiatriques.
Des modèles basés sur des rongeurs en développement ont identifié la théophylline comme facteur de risque de convulsions chez les jeunes enfants (Mares et al. 1994; Yokoyama et al. 1997). La neurotoxicité de l’hexachlorophène chez les nouveau-nés humains a également été modélisée sur des rats et des singes en développement (Towfighi, 1980). Ces résultats et bien d’autres sont cités par les directives de la FDA pour l’évaluation de la sécurité non clinique des médicaments pédiatriques (2006) pour expliquer la valeur de la recherche pédiatrique. La recherche citée dans le guide couvre les différences entre les systèmes adultes et enfants, comment les modèles animaux juvéniles aident à prédire la toxicité liée à l’âge ainsi que la toxicité post-natale.
L’approche de la carotte et du bâton pour augmenter les essais cliniques pédiatriques a eu un impact considérable sur l’augmentation du nombre de traitements sûrs disponibles pour les enfants. Cependant, tout comme pour les adultes, les médicaments destinés aux populations pédiatriques nécessitent des tests de sécurité avec des modèles animaux. La demande croissante d’essais cliniques pédiatriques a entraîné une augmentation corrélative de la demande d’essais précliniques sur des animaux juvéniles. L’ITR a répondu à cette demande en innovant de nouvelles méthodes pour les études sur les animaux juvéniles.
Le Travail d’ITR avec la Toxicologie Juvénile
Alors que les méthodes de dosage pour les animaux adultes sont bien établies depuis de nombreuses années, le dosage des animaux nouveau-nés est difficile en raison de leur petite taille. ITR a précédemment développé des méthodes pour le dosage intraveineux et le dosage par gavage oral chez les rats nouveau-nés, ainsi qu’un système d’identification utilisant des tatouages numériques par points permettant l’identification séparée de jusqu’à 9999 nouveau-nés différents. Nous avons également élargi nos méthodes de dosage pour les rats nouveau-nés pour inclure le dosage intratrachéal.
Malgré le format d’étude standard de 28 jours, l’administration intraveineuse chez les rats nouveau-nés était auparavant limitée à des études à dose unique à l’âge de 2 jours. La petite taille des rats nouveau-nés présente des défis techniques avec le dosage répété requis pour les études de 28 jours. L’utilisation typique de la veine caudale pour le dosage est impossible à l’âge de 2 jours en raison de la petite taille de la queue à cet âge.
Une lumière transluminante peut être utilisée pour localiser la veine temporale afin de permettre le dosage à ce stade. Avec le temps cependant, l’animal devient trop grand et la lumière n’est plus capable de révéler la veine. Au fur et à mesure que l’animal grandit, nous avons utilisé une approche veine / taille corporelle pour identifier d’autres veines possibles pour le dosage jusqu’à ce que la veine caudale soit suffisamment grande. Cette approche nous a permis de mener à bien une étude multidose typique de 28 jours.
De la même manière que les données cliniques pour adultes ne peuvent pas être généralisées aux enfants, les données précliniques recueillies auprès d’animaux adultes ne peuvent pas non plus être généralisées aux animaux juvéniles ou nouveau-nés. Les quelques essais cliniques pédiatriques qui sont menés s’appuieront souvent sur des données précliniques générées à partir d’animaux adultes, ce qui place un risque inutile sur les essais cliniques pédiatriques. Des données précliniques fiables à utiliser dans des études pédiatriques nécessitent des modèles animaux d’âge équivalent ou comparable aux populations pédiatriques humaines visées. En tant que tel, l’ITR a maintenant établi des données de référence sur l’hématologie et la biochimie de rats mâles et femelles Sprague Dawley âgés de 4, 7 et 21 jours. Ces données peuvent maintenant être utilisées comme point de comparaison pour de futures études avec des rats juvéniles.

Conclusion
Les enfants ont longtemps été considérés comme des orphelins thérapeutiques en raison de l’hypothèse selon laquelle ils ne sont que de petits adultes. La compréhension croissante des différences entre les enfants et les adultes, associée à l’approche Carrot & Stick de la FDA, a entraîné une augmentation constante de l’attention portée à la recherche pédiatrique et a conduit à une augmentation appréciable des informations sur l’étiquetage des médicaments pour la population pédiatrique.
Les modèles animaux ne peuvent être efficaces que s’ils peuvent prédire les effets dans la population cible. Lors du développement de médicaments pédiatriques, les modèles animaux adultes sont insuffisants pour faire des prédictions efficaces. En tant que tel, ITR s’est efforcé de renforcer les modèles animaux juvéniles en innovant de nouvelles méthodes de dosage pour un plus large éventail de plans d’étude. Alors que l’administration intraveineuse chez les nouveau-nés était auparavant limitée à une dose unique à l’âge de 2 jours, nous sommes désormais capables de réaliser des études à doses répétées sur 28 jours chez les nouveau-nés. Prenant en charge les méthodes de dosage par gavage oral, intratrachéal et intraveineux, ITR continue de surmonter les défis techniques des tests néonatals et juvéniles. L’établissement de données de référence hématologiques et biochimiques de base aidera à réduire les problèmes de comparaison des données adultes de base aux données juvéniles nouvellement générées, renforçant encore la fiabilité des modèles animaux juvéniles.
Avec des données pédiatriques précliniques plus fiables, le nombre de médicaments bénéficiant d’une approbation réglementaire pour un usage pédiatrique continuera d’augmenter. ITR continuera à jouer un rôle contributif en innovant de nouvelles méthodes de dépistage néonatal et juvénile pour aider à réduire le risque auquel les enfants sont confrontés en raison de prescriptions hors AMM et de résultats incorrectement généralisés à partir de données adultes.
