
Méthodes In Vitro, Toxicologie Génétique et les Trois R
Introduction
Lors de la prédiction des profils d’innocuité des médicaments en développement, les chercheurs se sont appuyés sur l’utilisation de modèles animaux, étant donné que les processus biologiques qui se produisent chez les animaux sont souvent également observés chez les humains.
Aujourd’hui, la recherche biomédicale met fortement l’accent sur la santé et le confort des animaux de recherche, sous la direction des 3R : remplacement, réduction et raffinement. Afin de continuer à améliorer le paysage éthique de la recherche préclinique tout en maintenant ou en améliorant la qualité des données scientifiques, des alternatives à la recherche animale sont en développement continu. Une telle alternative est l’utilisation de modèles in vitro.
Dans ce bulletin, nous approfondirons ce qu’est la recherche in vitro, ce qu’elle peut accomplir et comment elle se rapporte aux 3R. Nous présenterons également ce que l’ITR peut offrir en termes d’options in vitro et d’autres développements pour réduire, affiner et remplacer davantage les modèles animaux.


Qu’est-ce que la Recherche In Vitro et que Propose-t-elle ?
La recherche in vivo standard consiste à administrer un article test à un animal, à collecter des échantillons biologiques et à effectuer des tests pour évaluer les effets de la substance.
La recherche in vitro ne repose pas sur des modèles animaux vivants. Au lieu de cela, il est effectué en isolant les composants d’un organisme de son environnement biologique standard et en administrant l’article d’essai dans des milieux de culture artificiels. Le terme « in vitro » se traduit par « dans du verre » en latin ; l’utilisation de boîtes de Pétri, de tubes à essai et de flacons est standard avec la recherche in vitro.
Les méthodes in vitro ont évolué avec le temps. Aujourd’hui, ces méthodes aident à réduire et à affiner la recherche de plusieurs façons ; la recherche moderne sur le cancer, par exemple, utilise des anticorps monoclonaux (mAb) pour exploiter le système immunitaire humain afin de détruire les cellules cancéreuses. L’utilisation de mAbs limite les dommages systémiques qui résultent de la radiothérapie traditionnelle.
La dépendance à l’égard des animaux pour la production de mAbs a été réduite dans la recherche moderne grâce à l’utilisation de méthodes in vitro : au lieu de compter sur les animaux pour la production, les lignées cellulaires peuvent désormais être utilisées à la place.
Outre la production de réactifs, les méthodes in vitro permettent également aux chercheurs d’identifier plus rapidement des candidats-médicaments prometteurs grâce à l’utilisation de processus de criblage à haut débit. Les premières recherches sur l’efficacité peuvent être effectuées in vitro et les chercheurs peuvent également développer une compréhension mécaniste d’un composé et déterminer les voies impliquées avec une variété de paramètres toxicologiques avant que la recherche in vivo ne soit menée.
Dans l’ensemble, la recherche in vitro a fourni des méthodes pour rendre le processus de recherche plus efficace et a contribué à réduire le besoin d’utiliser des animaux.

Avantages et Limites de la Recherche In Vitro
Isoler les composants organiques des systèmes biologiques plus grands permet des conditions expérimentales hautement contrôlées, standardisées et facilement reproductibles. Les tests in vitro peuvent être effectués rapidement et sont relativement peu coûteux, nécessitant de plus petites quantités de matériel de test et limitant la quantité de déchets produits. C’est ce qui permet de cribler rapidement et efficacement une vaste bibliothèque de composés potentiels pour aider à cibler les candidats prometteurs aux premiers stades du développement de médicaments. Les tests in vitro peuvent également impliquer l’utilisation de cellules et de tissus humains pour identifier les problèmes potentiels dans la traduction des données animales pour les adapter aux applications humaines.
Bien que les tests in vitro soient utiles aux premiers stades du développement de médicaments, ils ne peuvent pas remplacer complètement la recherche in vivo. Afin de démontrer l’innocuité d’un médicament à usage humain, nous avons besoin de données pharmacocinétiques et pharmacodynamiques. Cela nécessite un système biologique complet et intact avec lequel le médicament peut interagir. Les tests in vitro n’étant effectués que sur des matériels biologiques isolés, ces données ne sont pas réunies. Les réactions entre les différentes cellules, tissus et organes ne peuvent pas être étudiées, pas plus que les effets causés par une exposition chronique.
Bien que des progrès aient été réalisés avec les organes artificiels à des fins de test, ils ne sont pas encore suffisamment développés pour fournir suffisamment de données pour faire des prédictions solides de sécurité chez l’homme.

Gamme de Services In Vitro ITR – Toxicologie Génétique
Tous les organismes de réglementation exigent un dépistage toxicologique génétique pour les nouveaux médicaments avant les essais cliniques. La plupart des tests de toxicologie génétique requis peuvent être effectués in vitro. Cependant, bien qu’il y ait eu de grands progrès avec le développement de méthodes génotoxiques in vitro, elles ne sont pas encore capables de remplacer entièrement les méthodes in vivo pour un profil de sécurité complet des médicaments en développement. La mutagénicité peut passer inaperçue in vitro, mais être ensuite découverte in vivo.
Les organismes de réglementation recommandent une batterie de tests de base du test de mutation bactérienne combiné au test in vitro du micronoyau (cellules CHO-k1). Cette combinaison renseigne sur trois types d’atteintes génétiques pour lesquelles des données sont nécessaires : la mutation génique, les modifications du nombre de chromosomes (aneuploïdie) et de leur structure (clastogénicité).
-
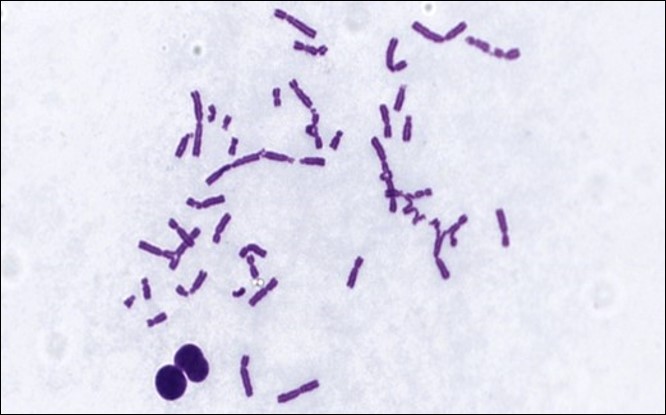
Test d’Aberration Chromosomique
-
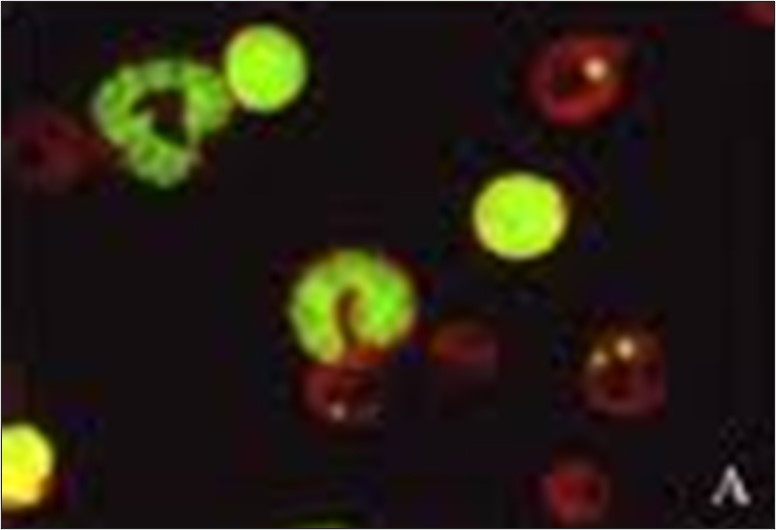
Dosage du Micronoyau
Le test d’aberration chromosomique in vitro, le test du micronoyau in vitro et le test de mutation génétique du lymphome de souris (MLA) sont actuellement considérés comme des tests appropriés pour l’évaluation du potentiel génotoxique d’un candidat-médicament (ICH S2-R1). Ceux-ci, ainsi qu’une variété d’autres tests de génotoxicité, font partie du portefeuille de capacités d’ITR.

Progrès des ITR Vers les 3R
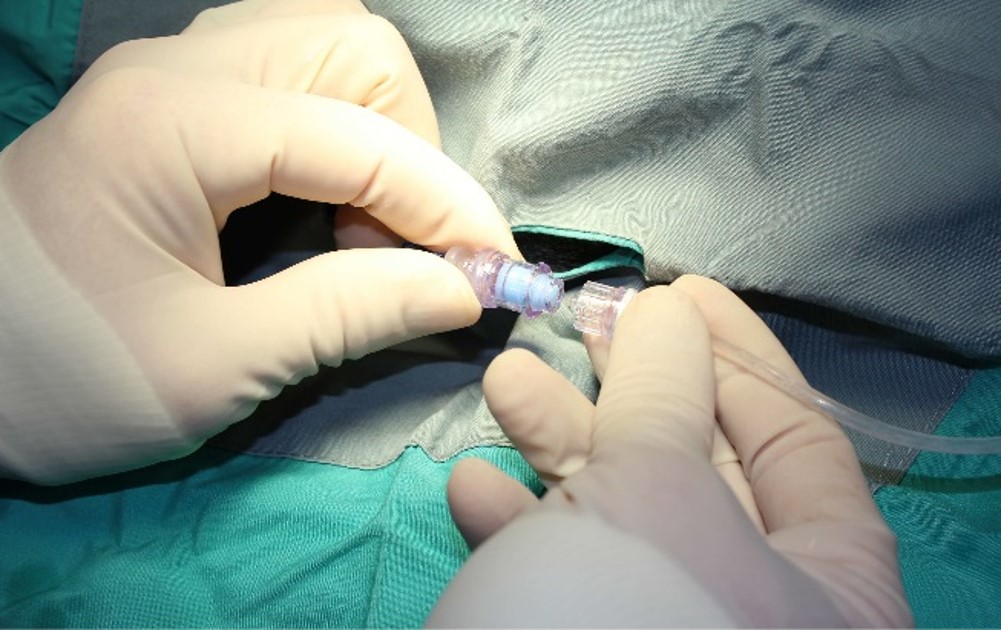
Au fil des ans, ITR a progressivement apporté des changements pour améliorer la vie de nos animaux de recherche. Des conditions de logement améliorées permettant plus d’espace, des programmes d’enrichissement plus développés et une technologie innovante comme le connecteur écouvillonnable du site d’injection sans aiguille qui permet aux chiens de faire de l’exercice pendant les études de perfusion continue ont été des développements importants.
Aujourd’hui, notre lecteur de plaques Quickplex Meso Scale Discovery (MSD) nous a permis d’affiner considérablement les essais sur plaque. Un ELISA standard nécessite 200 microlitres de sérum (environ 450 μL de sang) et permet de mesurer une seule cytokine à la fois. Cependant, le lecteur de plaques MSD permet de mesurer jusqu’à 10 cytokines. Cette technologie multiplex réduit également la quantité de sang requise par un facteur de 80 (2 mL vs 25 uL) tout en fournissant des résultats de meilleure qualité en réduisant les variabilités intra et inter-essais.

Conclusion
Alors que les méthodes in vitro ont connu des développements considérables ces dernières années, le remplacement complet des tests in vivo est encore loin de devenir une approche réaliste des tests de sécurité. ITR est toujours à la recherche de nouvelles façons de réduire, d’affiner ou de remplacer les modèles animaux. Les améliorations continues de nos procédures et de notre technologie ont apporté des différences significatives ; par exemple, avec le lecteur de plaques MSD Quickplex, ITR peut évaluer un plus grand nombre de biomarqueurs précliniques tout en prélevant beaucoup moins de volumes de sang, ce qui exerce moins de stress sur les animaux.
ITR restera toujours engagé à poursuivre le remplacement, la réduction et le raffinement pour aider à améliorer la vie des animaux de recherche.
