
Thérapeutique d’Anticorps
Thérapeutique d’Anticorps
Alors que la communauté médicale et scientifique mondiale se mobilise pour trouver une solution à la pandémie mondiale causée par le nouveau coronavirus, de nombreuses options différentes sont explorées. Les vaccins sont un moyen efficace d’empêcher la propagation des maladies transmissibles. Cependant, le développement de vaccins est un processus long, prenant souvent de 2 à 5 ans avant qu’ils ne soient prêts pour le public. Le nouveau coronavirus d’aujourd’hui n’est pas le premier coronavirus de l’histoire récente. Le SRAS-CoV-1 en 2003 et le MERS-CoV en 2012 étaient également des coronavirus et bien qu’ils aient eu un taux de létalité beaucoup plus élevé, ils étaient beaucoup moins contagieux. Dès la découverte du SRAS-CoV-1, les travaux ont commencé rapidement sur un vaccin. Il a fallu 4 mois aux scientifiques avant que la séquence du génome ne soit disponible pour développer des antigènes pouvant être utilisés pour des essais in vitro et in vivo sur des animaux. Ce n’est qu’en décembre 2004 que les premiers essais sur l’homme ont commencé, mais la maladie était alors bien maîtrisée et le développement du vaccin a finalement été interrompu.
Les sciences médicales ont beaucoup évolué depuis 2003 et le SRAS-CoV-2 avait été séquencé début janvier 2020. De nombreuses entreprises ont actuellement des candidats vaccins en essais précliniques et certaines ont déjà des candidats en essais sur l’homme. Contrairement aux coronavirus de 2003 et 2012, le SRAS-CoV-2 est beaucoup plus contagieux et le confinement n’est plus une option, il est donc peu probable que le développement d’un vaccin s’arrête avant la fin dans son cas.
Les vaccins aideront à empêcher les personnes en bonne santé de tomber malades, mais ceux dont le système immunitaire est affaibli ou certains problèmes de santé sous-jacents ne peuvent pas être vaccinés et la vaccination ne peut pas guérir ceux qui sont déjà malades. Pour protéger le plus grand nombre de personnes possible, il est nécessaire de développer des thérapies parallèlement aux vaccins. Parmi les options thérapeutiques actuellement en développement figurent les anticorps thérapeutiques. Ces traitements sont une forme d’immunisation passive par opposition à l’immunisation active conférée par la vaccination ou l’exposition naturelle.
Dans ce bulletin, nous discuterons de l’immunisation active et passive, des anticorps thérapeutiques et des considérations clés pour leur évaluation préclinique, et nous présenterons l’expérience d’ITR en matière de tests de sécurité pour les anticorps thérapeutiques.

Immunisation Active vs Passive
L’immunité active est le résultat de la production d’anticorps par l’organisme suite à une exposition à des molécules étrangères. Les anticorps sont produits par les lymphocytes B suite à l’activation de la réponse immunitaire adaptative et leur production peut être volontairement stimulée contre une cible spécifique par la vaccination à l’aide de versions affaiblies de l’agent pathogène d’intérêt. L’immunité acquise activement fournit généralement une protection durable en raison de la mémoire immunologique, qui provoque une réponse immunitaire plus rapide et plus puissante lorsque des agents pathogènes antigéniquement similaires sont détectés par l’organisme lors d’expositions futures. Bien que l’immunité active assure une protection à long terme, elle n’est pas pratique dans le cas de substances hautement toxiques ou pour des agents pathogènes avec de courtes périodes d’incubation en raison du délai entre l’introduction de l’antigène et la production d’anticorps.
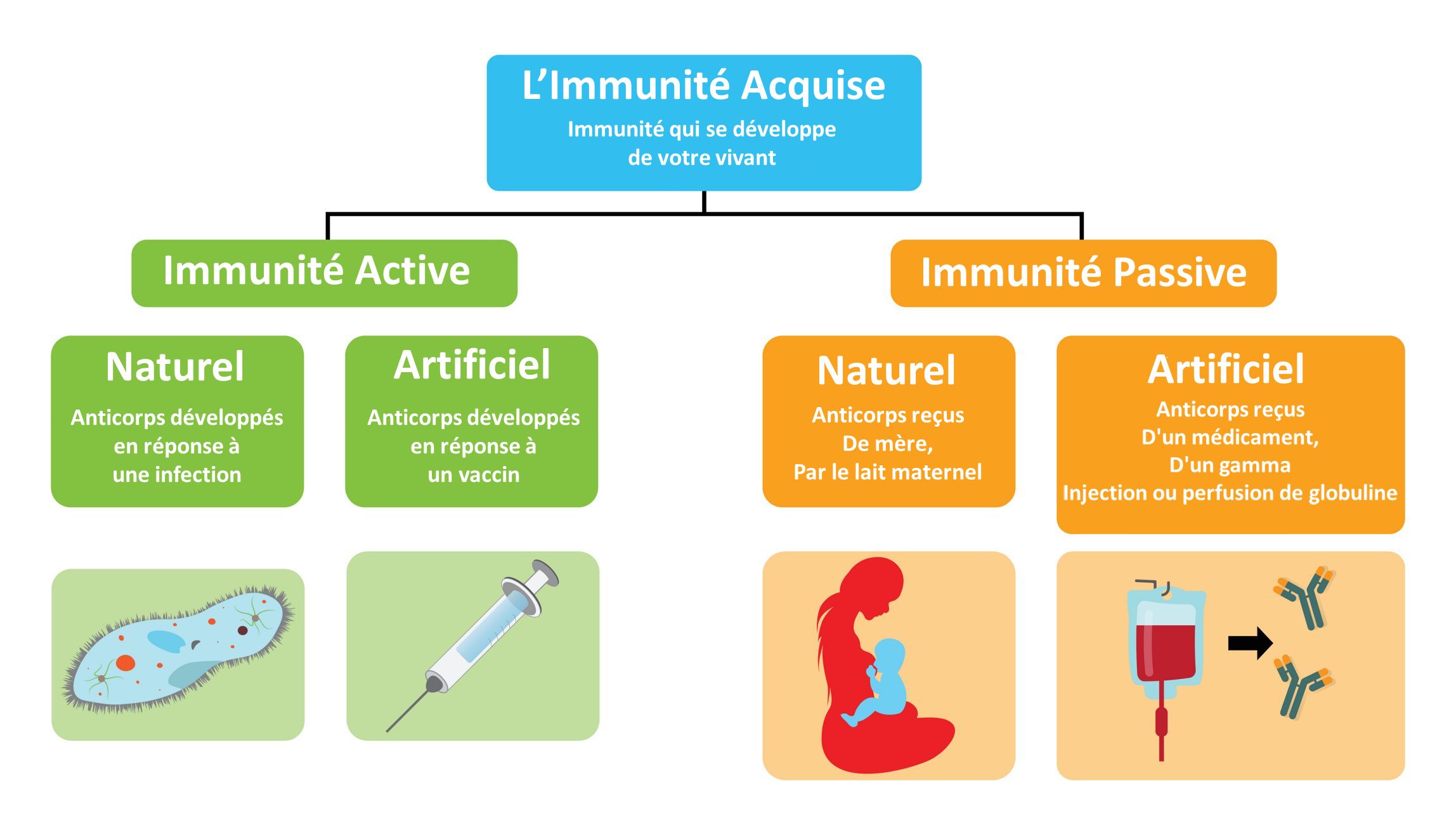
Les anticorps peuvent également être acquis auprès de sources externes pour fournir une immunité passive. Les nourrissons reçoivent des anticorps maternels par l’allaitement et les anticorps sont transférés au fœtus in utero. Des anticorps peuvent être prélevés sur ceux qui se sont remis d’une maladie infectieuse et injectés à ceux qui sont actuellement infectés pour aider à combattre l’infection. Des anticorps artificiels peuvent également être conçus et injectés à des fins thérapeutiques. Cependant, la durée de protection offerte par l’immunisation passive est plus courte que l’immunité active car le système immunitaire n’apprend pas à produire les anticorps nécessaires aussi efficacement et une infection future par des agents pathogènes antigéniquement similaires ne produira pas une réponse immunitaire suffisamment puissante.

Anticorps Thérapeutiques
Les anticorps sont utilisés comme thérapeutiques en médecine depuis la fin du 18e siècle. Le botulisme, la diphtérie et le tétanos ont tous été traités avec des anticorps thérapeutiques. Ces anticorps ont été produits en injectant aux animaux un antigène pour induire une réponse immunitaire chez l’animal. Du sang a ensuite été prélevé et le sérum riche en anticorps a été injecté à des patients humains. Les anticorps trouvés dans le sérum sont connus sous le nom d’anticorps polyclonaux (pAb) parce qu’ils sont produits à partir de plusieurs populations clonales de cellules B et qu’ils sont capables de se lier à plusieurs épitopes différents d’un même antigène.
À l’époque, ce processus s’appelait la sérothérapie. Les antisérums équins ont montré quelques succès dans le traitement des maladies liées aux toxines ainsi que de certains virus tels que la poliomyélite et la grippe. Bien que le sérum d’origine animale ait montré certains effets thérapeutiques positifs, il y avait cependant de nombreux défis liés à l’immunisation des animaux, à la variabilité d’un lot à l’autre du sérum et aux effets secondaires indésirables chez l’homme.
Le plasma humain et les immunoglobulines provenant d’humains convalescents ou immunisés ont été utilisés vers les années 1930 et sont encore utilisés aujourd’hui pour traiter les enfants présentant des déficiences en anticorps. Bien que généralement plus sûres que le sérum animal, les thérapies par anticorps d’origine humaine posaient toujours le risque de transmettre des infections comme l’hépatite B et C. La thérapie sérique est tombée en disgrâce après l’émergence des antibiotiques et des sulfamides pour le traitement de la plupart des infections bactériennes dans les années 1930 à 1940.
Le développement de la technologie des hybridomes en 1975 a permis la production en masse d’anticorps identiques appelés anticorps monoclonaux (mAbs), qui démontrent une forte affinité pour un épitope unique sur la cible. Cette technologie a éliminé une grande partie des charges associées à la production et à l’utilisation de pAb d’origine animale ou humaine. Les premières générations de mAbs ont connu des succès cliniques limités en raison de leurs origines animales, ce qui a entraîné une faible interaction avec la biologie humaine. Aujourd’hui, les mAb sont conçus avec des cadres entièrement humains pour réduire l’immunogénicité causée par les mAb d’origine animale. Ces anticorps sont aujourd’hui utilisés pour traiter une grande variété de maladies inflammatoires telles que la polyarthrite rhumatoïde et divers cancers, ainsi que des infections virales comme la grippe. Les thérapies par anticorps peuvent également être utilisées pour offrir une protection à court terme à ceux qui ne peuvent pas être vaccinés.
Malgré les avantages, même les mAb humanisés présentent des problèmes de sécurité et des complications qui nécessitent une évaluation préclinique minutieuse.

Évaluation Préclinique des Anticorps Thérapeutiques
Les anticorps monoclonaux ont éclipsé l’utilisation des anticorps polyclonaux en raison de procédés de fabrication plus fiables, d’une meilleure caractérisation du mode d’action, de meilleurs profils de sécurité et de la capacité à traiter un plus large éventail de maladies humaines. Comme pour les autres formes de médicaments, les essais précliniques ont pour objectif de fournir toutes les informations nécessaires à la réalisation d’essais humains sûrs : détermination d’une dose initiale sûre, identification des organes susceptibles d’être ciblés pour la toxicité, identification des paramètres de surveillance de la sécurité chez l’homme et si toute toxicité observée est réversible.
En tant que tels, les paramètres souvent mesurés dans le cadre de l’étude d’évaluation de l’innocuité non clinique comprennent l’analyse de la concentration de l’élément d’essai dans les formulations de dose, les observations cliniques, les mesures du poids corporel et de la consommation alimentaire, les évaluations ophtalmologiques, les évaluations de l’effet potentiel des mAbs sur le système cardiovasculaire, respiratoire et nerveux central, ainsi que des évaluations de pathologie clinique (hématologie, coagulation, chimie clinique et analyse d’urine). Une série d’échantillons de sang est également prélevée le premier et le dernier jour de l’administration à des moments sélectionnés par rapport au traitement et utilisée pour l’analyse des concentrations des éléments de test dans le plasma/sérum et le calcul ultérieur des paramètres toxicocinétiques. Des échantillons de sang supplémentaires sont également souvent prélevés à des moments choisis par rapport au traitement, et en fonction de la cible et du mécanisme d’action de l’anticorps, utilisé pour l’immunophénotypage, l’analyse des taux de cytokines, la réponse anticorps dépendante des cellules T (TDAR), la présence de des anticorps anti-médicament et/ou d’autres biomarqueurs.
L’obtention de l’approbation réglementaire pour tester de nouveaux produits médicamenteux chez l’homme nécessite des tests sur deux espèces animales pertinentes. Cependant, comme pour d’autres médicaments biologiques, les mAb ne sont souvent pas pharmacologiquement actifs chez la plupart des espèces d’animaux de laboratoire, et donc la réalisation du programme de sécurité non clinique chez une espèce pertinente est souvent suffisante pour satisfaire aux exigences réglementaires.

Travail d’ITR avec Antibody Therapeutics
L’équipe d’experts en immunologie d’ITR est formée et équipée pour effectuer tous les tests précliniques requis pour les médicaments à grandes molécules, y compris les mAb, chez les grands et les petits animaux. ITR propose une large gamme de types et de formats d’analyses BPL in vitro, y compris, mais sans s’y limiter : l’analyse de la formulation de dose par absorbance et fluorescence, la bioanalyse par ELISA ou ECL, ainsi que les analyses de biomarqueurs BPL et non BPL utilisées pour évaluer la pharmacodynamique et toxicités d’organes.
D’autres tests BPL in vitro et in vivo plus spécifiques aux anticorps comprennent : les tests standard de réponse des anticorps dépendants des cellules T (TDAR) de rat et de singe, le test d’activité des cellules tueuses naturelles, l’immunophénotypage, l’occupation des récepteurs et les tests multiplex de cytokines par Meso Scale Discovery ( MSD) ou des réseaux de billes cytométriques. ITR peut également effectuer la validation BPL ou la qualification non BPL d’un nouveau biomarqueur sur demande. Pour une liste complète des biomarqueurs actuellement disponibles, cliquez ici.
Notre équipe flexible peut prendre en charge toutes les demandes d’analyses avancées et le développement de méthodes est toujours effectué pour répondre aux normes BPL, même pour les projets non BPL.

Conclusion
Alors que la course au vaccin contre le nouveau coronavirus continue d’être au centre de l’attention du public, des traitements thérapeutiques sont développés en parallèle. Bien que les vaccins soient un outil puissant dans la lutte contre les maladies infectieuses, ils ne constituent pas une solution fourre-tout : pour être efficaces, les vaccins doivent être administrés avant l’exposition au virus. Résoudre cette crise nécessitera à la fois des traitements prophylactiques sous forme de vaccins pour stopper la propagation du virus et des médicaments thérapeutiques pour aider à sauver la vie de ceux dont l’état ne permet pas la vaccination. Les traitements par anticorps sont polyvalents dans leurs applications en servant de thérapeutique pour une grande variété d’indications, telles que les maladies inflammatoires, les cancers et les infections virales, ainsi que de prophylactique en fournissant une immunité passive à court terme pour ceux qui ne sont pas vaccinés.
ITR est équipé et prêt à aider à gérer cette crise en fournissant des profils de sécurité complets pour les traitements, qu’il s’agisse de vaccins ou d’anticorps thérapeutiques.
