
Innocuité Préclinique vs Recherche d’Efficacité
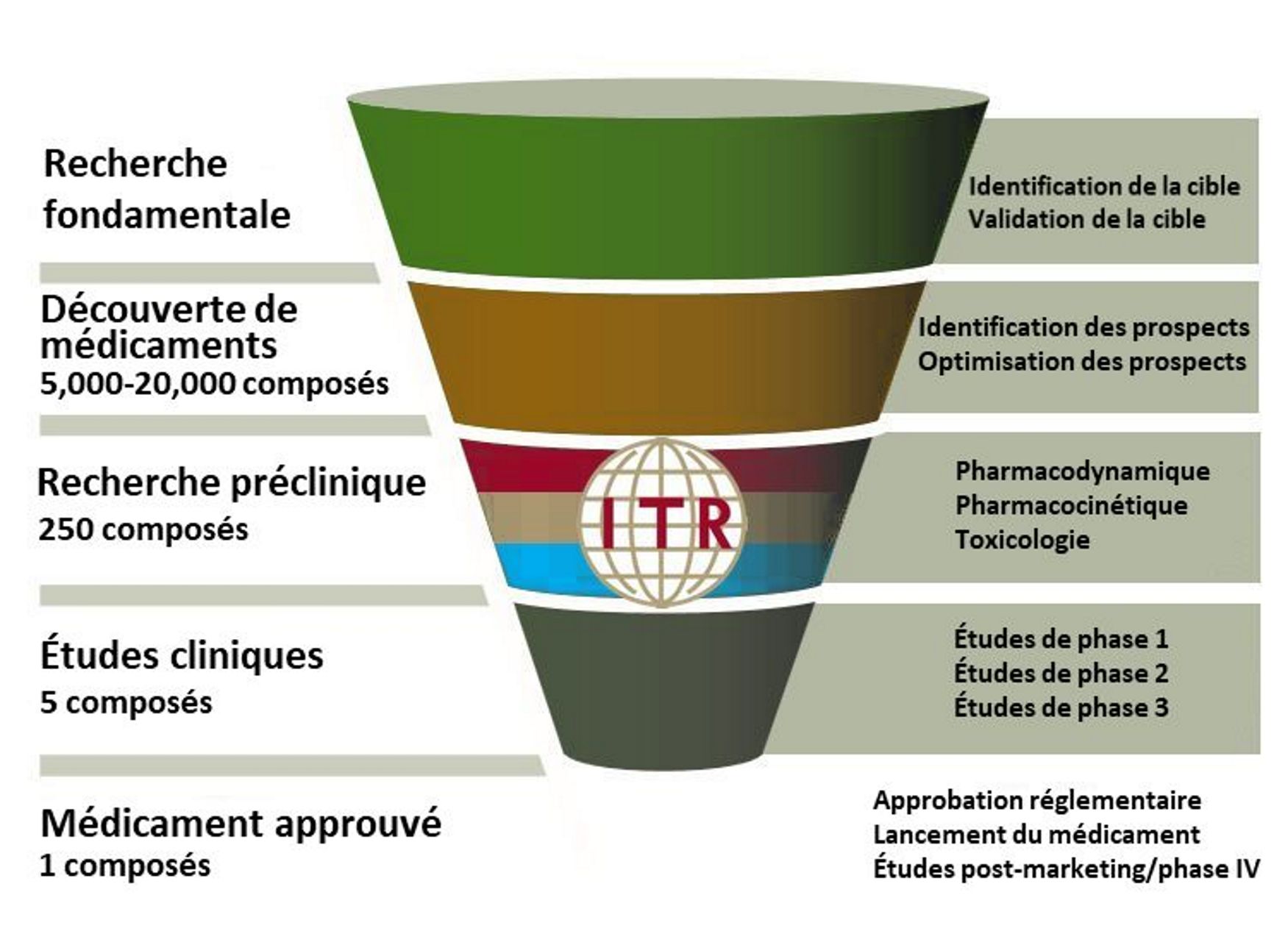
Le processus de mise sur le marché d’un nouveau médicament depuis les premiers stades de développement nécessitera environ 12 ans et un coût estimé à 1 milliard de dollars. Bien que la phase de développement la plus coûteuse soit celle des essais cliniques, en particulier la phase 3, le succès éventuel de ces essais nécessite une base solide de recherche préclinique efficace.
La majorité des médicaments qui passent avec succès le stade préclinique finiront par échouer dans les essais cliniques, entraînant des pertes financières importantes ainsi qu’une perte de temps de recherche qui aurait pu être mieux dépensé sur des candidats-médicaments plus prometteurs.
Les trois principales raisons citées pour ces échecs sont le manque de soutien financier, l’incapacité à démontrer l’efficacité chez l’homme et les problèmes de sécurité.
Dans cette bulletin, nous décrirons la recherche sur l’innocuité et la recherche sur l’efficacité dans un contexte préclinique, nous discuterons des problèmes communs avec la recherche préclinique sur l’efficacité et nous présenterons les services précliniques des ITR.
Recherche Préclinique sur l’Innocuité
Qu’est-ce qu’un médicament sûr exactement ? La sécurité dépendra de plusieurs facteurs. Quel est le médicament destiné à traiter? Quelle est la population cible ? Quelles sont les conditions d’utilisation prévues du médicament ? Les réponses à ces questions différeront d’un médicament à l’autre et indiqueront ce qui constitue un médicament sûr.
Lors du traitement de maladies potentiellement mortelles, le concept de médicament sûr sera différent des traitements conçus pour un mal de tête ou un rhume. La perte de cheveux et les nausées sévères seraient des effets secondaires inacceptables pour les médicaments contre le rhume, mais sont attendus et tolérés avec de nombreux traitements contre le cancer, cela est dû aux différences de risque acceptable. Un médicament peut être considéré comme sûr pour les adultes, mais pas pour les enfants ou les personnes âgées. Les interactions médicamenteuses peuvent également compromettre la sécurité lorsqu’il s’agit de conditions comorbides et de polypharmacie.
La recherche préclinique sur l’innocuité est requise par tous les organismes de réglementation afin de minimiser le risque que présentent les nouveaux candidats-médicaments pour l’homme au cours des essais cliniques.
Le but de la recherche préclinique sur l’innocuité est de prédire le risque, une fois que le risque a été prédit chez les animaux, l’étape suivante consisterait à évaluer l’innocuité et l’efficacité du médicament chez l’homme.

Recherche d’Efficacité Préclinique
Alors que la recherche sur l’innocuité vise à évaluer le niveau de risque associé à un médicament, l’efficacité préclinique est axée sur la prédiction des avantages du médicament.
La recherche préclinique sur l’efficacité vise à établir si le médicament fonctionnera pour traiter la maladie cible ou la maladie dans la population visée dans des conditions d’utilisation spécifiées. Contrairement à la recherche préclinique sur l’innocuité, les études d’efficacité ne sont pas requises par les organismes de réglementation dans la phase préclinique et il n’existe pas de lignes directrices claires pour la recherche préclinique sur l’efficacité.
Des recherches d’efficacité sont parfois menées dans le domaine de l’oncologie avec la xénogreffe et avec certaines maladies spécifiques pouvant être induites ou retrouvées chez certaines espèces animales, comme le diabète de type 1 chez le rat nude. Les résultats des études d’efficacité précliniques peuvent aider à fournir des données plus solides pour faire progresser le candidat vers les essais cliniques.
La recherche d’efficacité préclinique est rarement effectuée. Le manque de directives réglementaires et la nature coûteuse du développement de médicaments en général ont un effet dissuasif, mais les défis vont au-delà du manque de directives et des contraintes financières.

Problèmes Courants Liés à la Recherche sur l’Efficacité
Au-delà des contraintes financières, la recherche sur l’efficacité est souvent omise en raison du manque de preuves pour soutenir le développement de médicaments au-delà des tests de sécurité standard. Les résultats d’efficacité ne se traduisent souvent pas en recherche clinique.
Afin de tester l’efficacité chez les animaux, l’état pathologique doit être créé dans des modèles animaux et une réactivité croisée avec le médicament doit être démontrée, ce qui réduit le nombre d’espèces disponibles pour les tests. Dans les modèles animaux, l’état pathologique est induit de diverses manières, mais ces conditions entraîneront souvent un déclenchement et une progression de la maladie différents par rapport aux conditions pathologiques humaines standard.
Le cadre rigoureusement contrôlé du laboratoire ne peut pas non plus rendre compte de la diversité des populations humaines en termes d’âge, de multimorbidité et de polypharmacie.
Dans les laboratoires contrôlés, la maladie est souvent traitée plus tôt que la norme dans les populations humaines. La maladie humaine n’est souvent traitée qu’une fois que les symptômes commencent à se manifester, ce qui peut être long après que la maladie a pu être détectée et diagnostiquée. Cela contraste avec le cadre de recherche où la maladie est induite et peut être traitée plus tôt.
Sans contrôle de tous ces facteurs, la validité externe des résultats est compromise, l’efficacité du médicament peut alors être surestimée ou sous-estimée. Tant que nous pouvons prédire le niveau de risque qu’un nouveau médicament représente pour l’homme au cours des essais cliniques, l’efficacité est mieux étudiée chez l’homme.
Capacités d’Etude de Sécurité Chez ITR
ITR se spécialise dans la recherche préclinique sur la sécurité, après 30 années de fonctionnement fructueuses, notre personnel expert peut offrir une gamme diversifiée de services de toxicologie.
Nos principaux services de toxicologie comprennent l’administration de médicaments par voie orale, par inhalation, par voie intraveineuse (bolus et perfusion continue), sous-cutanée, intramusculaire, cutanée et oculaire, ainsi que des études d’immunotoxicologie, de toxicologie génétique et de pharmacologie de sécurité.
Avec plus de 6000 études précliniques réalisées avec succès, ITR possède une vaste expérience et propose une large gamme d’études de sécurité. Nous pouvons tester sur de petites et grandes molécules chez les petits et les grands animaux sur un seul site. Nous pouvons tester toutes les phases du développement préclinique, y compris les études IND permettant ainsi que les NDA, allant des études aiguës aux études de cancérogénicité.

Conclusion
La recherche préclinique est une étape obligatoire pour produire des médicaments sûrs et efficaces. Bien que l’efficacité soit parfois testée en préclinique, l’absence de directives réglementaires et les résultats peu fiables remettent en question sa valeur. La valeur douteuse de la recherche soulève également des préoccupations éthiques, la minimisation de l’utilisation inutile d’animaux est un facteur déterminant dans la recherche effectuée.
ITR s’engage à fournir la recherche de sécurité préclinique de la plus haute qualité, une communication directe avec notre direction scientifique aide nos clients à faire progresser en douceur leurs candidats-médicaments jusqu’à la clinique.
